Посилання на першу частину: https://buki.com.ua/blogs/khochesh-zhyty-vmiy-krutytysya-abo-pro-zhyttya-ta-pobut-elektroniv-chastyna-1/
Посилання на другу частину: https://buki.com.ua/blogs/khochesh-zhyty-vmiy-krutytysya-abo-pro-zhyttya-ta-pobut-elektroniv-chastyna-2/
ДИСКЛЕЙМЕР: Увага! Не всі питання, описані у цій статті, розглядаються шкільною програмою. Наша редакція не несе відповідальності за ймовірні знання на навички, які ви можете отримати після прочитання даної інформації.
Все в природі прагне досягнути рівноваги та стабільності. Такої особливості дотримуються всі тіла та об’єкти нашого Всесвіту від неймовірно величезних до мікроскопічних. Зірки – об’єкти з настільки колосальними запасами енергії, що здатні давати життя цілим системам планет – один із найяскравіших прикладів рівноваги. Адже вони здатні «жити» тільки тоді, коли сили, що направлені на розширення зірки (термоядерні реакції в середині ядра), зрівняються з силами, що її стискають (власна гравітація). Рівновагу ми постійно спостерігаємо у повсякденному житті: залиште чашку з гарячим чаєм на столі за кімнатної температури, і її температура буде падати доти, доки не порівняється з температурою кімнати. Що ж до одних з найменших об’єктів Всесвіту – атомів загалом та електронів зокрема, то й вони всіма силами прагнуть до встановлення рівноваги, але своїм специфічним способом – шляхом мінімізації енергії. Про це ми вже згадували і не раз: електрон займає положення якнайближче до ядра (принцип мінімуму енергії), електрони заповнюють в першу чергу ті підрівні, енергія яких менша (правило Клечковського). Все це приклади способів досягнення тієї самої мінімізації. Але, виявляється, енергетично вигідними можуть бути не тільки конкретні розташування електронів, але й певні електронні структури.
Електронний октет. Погляньте на електронну конфігурацію атома Неону (Ne).
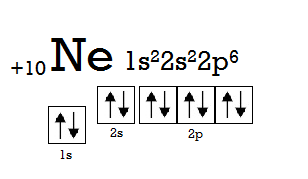
Не важко помітити особливість, яка відрізнятиме його від інших атомів, а саме, s- та p-підрівні зовнішнього енергетичного рівня повністю заповнені електронами (у випадку атома Неону зовнішнім є другий енергетичний рівень). Така електронна оболонка елемента називається електронною оболонкою благородного газу, а сам Неон – благородним або інертним газом. Інша назва такої оболонки – електронний октет (лат. octo – вісім), так як складається вона з 8 електронів. Ця структура є настільки енергетично вигідною, що атом Неону щосили намагатиметься її зберегти, а тому не буде вступати в реакції з жодним іншим атомом (звідси й назви «інертний», «благородний»). Крім Неону, електронний октет присутній майже у всіх елементів 18 групи (VIIIAгрупи за застарілою класифікацією) Періодичної системи: Аргону (Ar), Криптону (Kr), Ксенону (Xe), Радону (Rn), Оганесону (Og). Тому всі ці елементи (крім Og, який наразі маловивчений) є інертними газами. Але є ще один елемент на вершині 18 групи – Гелій. Це також благородний газ. Його зовнішній енергетичний рівень (перший) не може вмістити октету електронів (так як на першому енергетичному рівні немає p-підрівня), проте він все ж є завершеним, а тому також достатньо стійким.
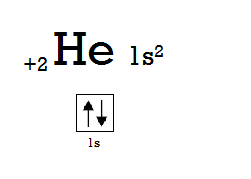
Всі інші елементи , вступаючи в реакції, будуть намагатися побудувати такий самий електронний октет у себе на зовнішньому енергетичному рівні. Для цього вони будуть віддавати зайві електрони або ж приймати стільки, скільки їм бракує до завершення октету.
Електронний провал. Продовжуючи тему енергетично вигідних комбінацій електронів, давайте розберемо послідовність заповнення 3d-підрівня.
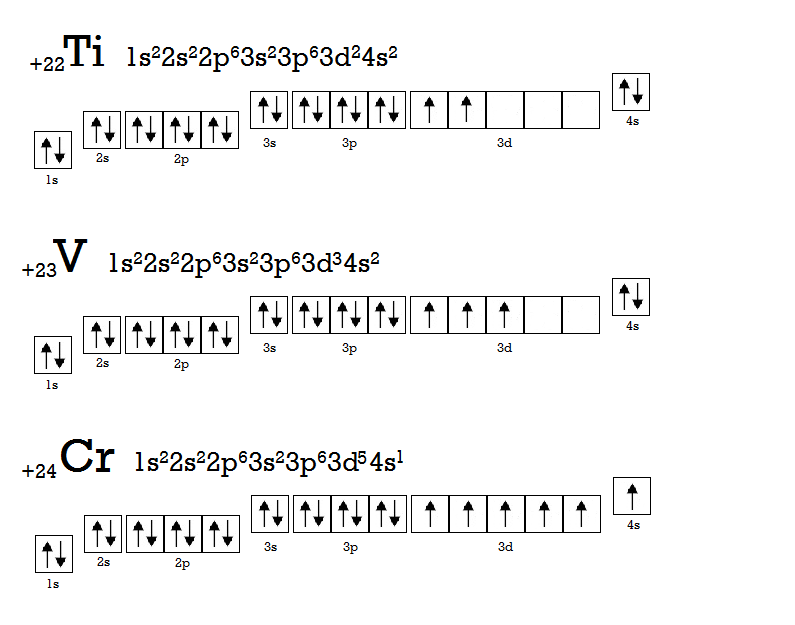
Помітили збій? У атомі Хрому (Cr) електрон перескочив з 4s-підрівня на 3d-підрівень. Причиною цього є та сама наша улюблена мінімізація енергії. Більш вигідною є ситуація, коли на d-підрівні знаходиться 5 або 10 електронів. Приклад з 10 електронами ілюструє атом Купруму (Cu).
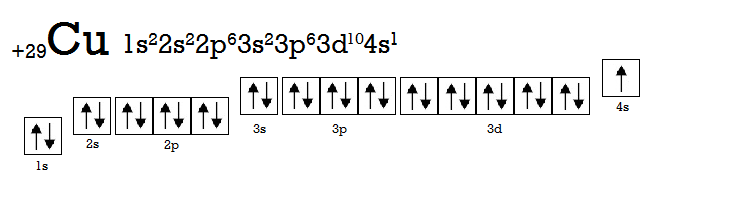
Таке явище називають провалом електрона. Крім атомів CriCu, провал з s-підрівня на d-підрівень також характерний для таких елементів: Ніобій (Nb), Молібден (Mo), Рутеній (Ru), Паладій (Pd) (тут взагалі провалюється 2 електрони), Аргентум (Ag), Платина (Pt), Аурум (Au). Існують і інші види провалів у елементів, що належать до актиноїдів та лантаноїдів, але їх, на жаль (чи на щастя), ми обговорювати не будемо.
Квантові числа. Якщо слово «квантовий» не викликає у вас сильної довіри, не панікуйте. Насправді, тут все не так страшно, як було до цього. І зараз я це доведу. Отже, як би багато електронів не знаходилось навколо ядра (1, 10, 20, 100), ми ніколи не знайдемо серед них двох однакових. В попередній статті ми сформували принцип заборони Паулі, який забороняв двом однаковим електронам знаходитися на одній атомній орбіталі. А тепер ми його доповнимо до кінця. Насправді, принцип Паулі забороняє існування двох однакових електронів в атомі в цілому. Кожен електрон унікальний і описується своїм індивідуальним набором з чотирьох квантових чисел. Все ще дуже складно, і хотілося б легше? Добре. Давайте уявимо опис електрона так, ніби ми записуємо його адресу. Якою є послідовність запису традиційної адреси? Країна – місто – вулиця – номер будинку (від більш загального до більш детального). Кожну з цих складових в описі «адреси» електрона можна замінити числом. Як ми вже сказали, квантових чисел чотири.
1. Головне квантове число (країна) – чисельно відповідає номеру енергетичного рівня, на якому знаходиться електрон. Позначається n. Отже, для всіх електронів, що знаходяться на першому енергетичному рівні, n = 1. Для всіх на другому n = 2. Третьому – n = 3 і т.д.
2. Орбітальне квантове число (місто) – описує форму атомної орбіталі, на якій перебуває електрон. Позначаєтьсяl (ель). Залежно від форми орбіталі може мати такі значення:
- для всіх електронів, що перебувають на s-орбіталях І = 0;
- для тих, що перебувають на р-орбіталях І = 1;
- на d-орбіталях І = 2;
- на f-орбіталях І = 3.
3. Магнітне квантове число (вулиця) – описує спосіб розташування орбіталі в просторі. Позначають mабо Ml. Може набувати різних значень в залежності від способу розташування орбіталі.
- s-орбіталь має тільки один спосіб розміщення в просторі:
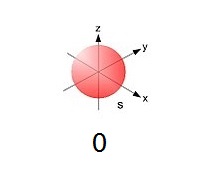
Відповідно число для опису способу її розташування тільки одне – m = 0. Саме таке значення магнітного квантового числа буде у всіх електронів, що знаходятьсяна даній орбіталі.
- три р-орбіталі розміщуються в просторі трьома різними способами:
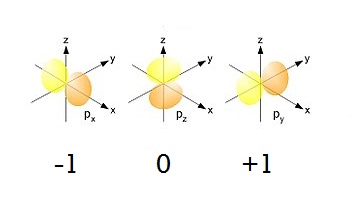
Отже, чисел для опису розміщення потрібно вже три: m = -1; m = 0; m = +1.
- для п’яти d-орбіталей способів п’ять. Чисел теж п’ять: m = -2; m = -1; m = 0; m = +1; m= +2;
- для f-орбіталей – сім: m = -3; m = -2; m = -1; m = 0; m = +1; m = +2; m = +3.
4. Спінове квантове число (номер будинку) – характеризує спін електрона. Позначається sабо Ms. Може набувати тільки двох протилежних значень: s = +1/2; s = -1/2.
А тепер спробуємо описати квантовими числами один з електронів атома Купруму (Cu), позначений на малюнку червоною стрілкою.
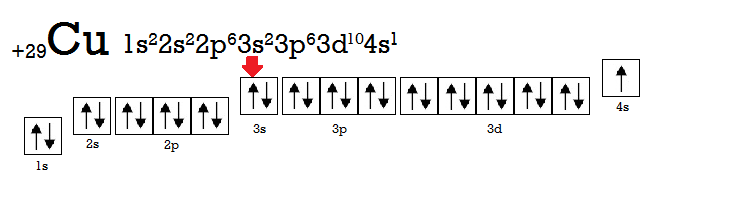
Головне квантове число відповідає номеру енергетичного рівня, на якому знаходиться електрон, тому n = 3. Даний електрон розміщений на s-орбіталі, томуорбітальне квантове число –l = 0. Так як орбіталь розміщується в просторі тільки одним способом, то й магнітне квантове число для його позначення єдине: m = 0. І, нарешті, призначимо спінове квантове число: s = +1/2. Отже, опис даного електрона за допомогою квантових чисел виглядатиме так: n = 3, I = 0, m = 0, s = +1/2.
Правило Клечковського (доповнення). Тепер, коли ми знаємо про квантові числа, сформулюємо правило Клечковського в його повному вигляді. Заповнення електронами орбіталей в атомі відбувається в порядку зростання суми головного та орбітального квантових чисел (n+l). При однаковій сумі раніше заповнюватиметься орбіталь з меншим значенням головного квантового числа (n). Розберемо по порядку. Для 4s-підрівня сума головного і орбітального квантових чисел складає: n+l=4+0=4. Для 3d-підрівня: n+l=3+2=5. 4s-підрівень заповнюється раніше, так як на цьому підрівні дана сума менша. А у випадках, коли сума однакова (наприклад, у 2p (2+1)та 3s-підрівнів (3+0)), опираємося на менше головне (n) квантове число (воно менше у 2p-підрівня (n = 2), тому й він заповнюється раніше).
На цьому ми завершимо історію про електрони. Ось і все, що я хотів вам про них розповісти. Сподіваюсь, дана інформація допоможе вам краще зрозуміти матеріал шкільної програми, успішно скласти ЗНО з хімії або підготуватися до вивчення більш серйозних тем у ВНЗ. Дякую, що дочитали до кінця!




