
Таблиця Менделєєва містить у собі фундаментальні знання для всіх охочих вивчати природничі науки. Не знаючи хімічних елементів, ви втрачаєте основу знань, а водночас і можливість пізнати багатий світ хімії. Але далеко не всім вдається запам'ятати таблицю Менделєєва, тому в цьому матеріалі ви зможете дізнатися про те, за яким принципом вона влаштована, і які знання допоможуть вам використовувати її без особливих зусиль.
Що таке періодична система елементів?
Початковий варіант хімічної таблиці, представлений ще в далекому 1869 році, відрізнявся від сьогоднішнього, та супроводжував відкриття періодичного закону Д.І.Менделєєвим. З кожним новим відкриттям вчених про атоми та їх властивості це формулювання зазнавало змін, але на сьогодні актуальне наступне:

Як можна здогадатися, таблиця - це не що інше, як наочне зображення вищезазначеного закону.
Читайте також: Як написати СV для вступу за кордон?
Як зрозуміти структуру таблиці Менделєєва?
Перш ніж приступати до вивчення таблиці хімічних елементів, потрібно в ній розібратися і зрозуміти, як вона влаштована, а саме: що означає кожен стовпчик, рядок і літери в комірках.
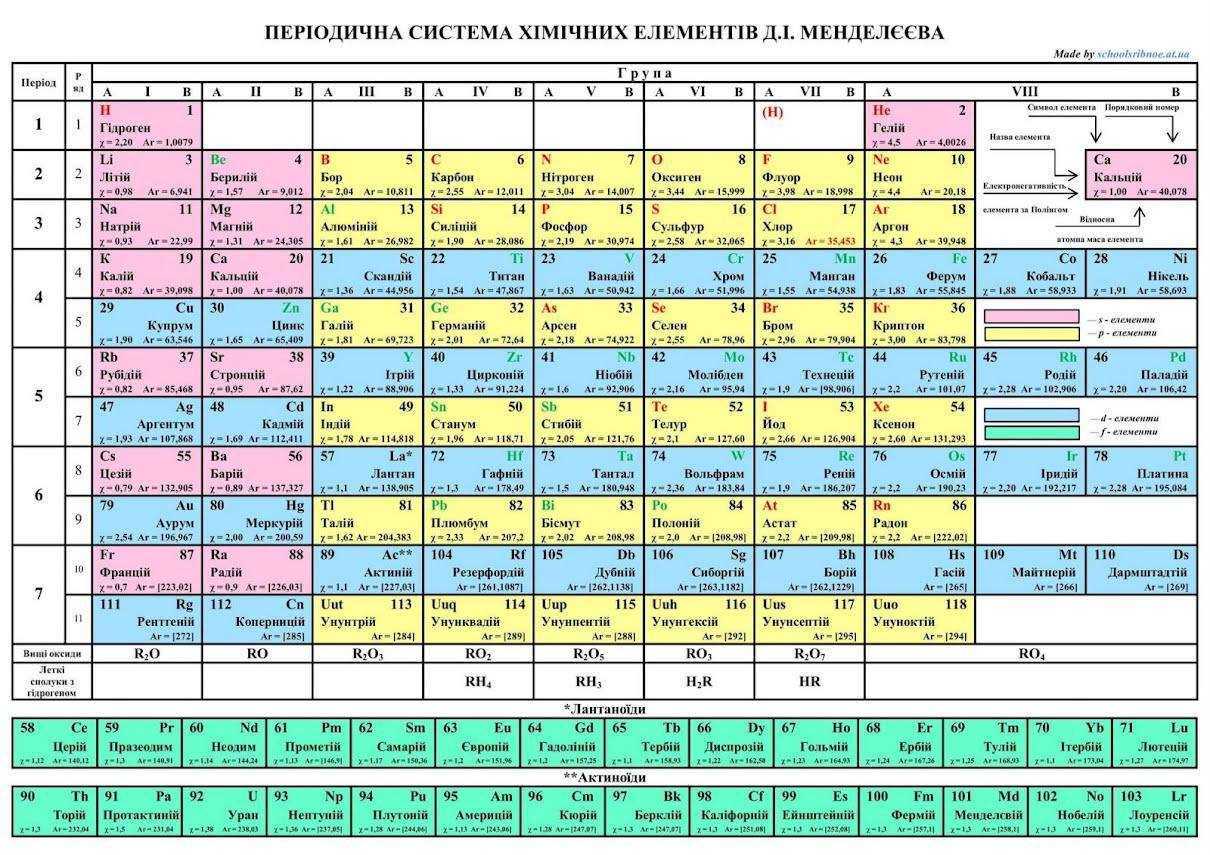
Отже, у самій таблиці можна побачити як горизонтальні, так і вертикальні ряди. Перші з них називаються періодами, другі - групами. Зверніть увагу, що деякі з горизонтальних періодів (з 4 по 7) включають по два ряди з елементами, тому вони називаються великими, а перші три - малими. Знизу ви бачите два ряди зеленого кольору – це елементи 6-го та 7-го періодів, винесені в окремі групи – лантаноїди та актиноїди.
Серед вертикальних рядів виділяється 8 груп (хоча в початковому вигляді їх було всього 7, адже тоді ще не були відкриті інертні гази). Кожна група включає головну і побічну підгрупу елементів. Ті, що розміщені праворуч комірок - головні, ліворуч - побічні (іноді у таблицях ці підгрупи позначаються буквами “а” і “б” або цифрами “1” і “2” відповідно). У побічній підгрупі можна побачити елементи лише великих періодів. Запам'ятайте, що номер групи, який вказується зверху таблиці, відповідає кількості електронів на зовнішньому енергетичному рівні елементів, що належать до неї, а також показує вищу валентність, або найвищий (позитивний) ступінь окиснення.
Під останнім періодом у таблиці є ще два рядки, на які варто звернути увагу. Перший з них - вищі оксиди - показує найвищий ступінь окиснення елементів (замість формульної літери R потрібно просто вставити потрібний вам елемент, і оксид буде готовий). Другий рядок - леткі сполуки з гідрогеном - показує елементи в нижчих ступенях окиснення. Визначається вона досить просто - потрібно від 8 відняти число, що відповідає номеру групи елемента.
Усі елементи перебувають у таблиці за збільшенням заряду їхніх ядер. На прикладі хімічного елемента Zn (Цинк) розглянемо, яка інформація міститься в окремо взятій комірці:
- символ елемента – Zn + назва – Цинк;
- заряд його ядра - 30 (водночас це порядковий номер у таблиці);
- відносна атомна маса - 65,37 (оскільки це число дробове, то при розв'язанні задач його просто заокруглюють);
- розподіл електронів за енергетичними рівнями - 2, 18, 8, 2 (сума дорівнює порядковому номеру). Кількість таких рівнів відповідає номеру періоду (тут їх 4, тому що Zn знаходиться в 4-му ряді).

Крім заряду ядра атома, порядковий номер в комірці дорівнює також числу електронів в атомі та протонів в ядрі.
Основні елементи таблиці Менделєєва
Вище ви познайомилися із коротким варіантом таблиці, де представлено 8 груп хімічних елементів. Також є довгий варіант із 18-ма групами.

Основними в хімії називаються елементи, що містяться в 1-2 (лужні та лужноземельні метали) та 13-18 групах (бор, карбон, азот, халькогени, галогени та інертні гази). Вони вважаються найбільш поширеними у світі та становлять близько 80% від загальної маси земної кори.
Читайте також: Метод асоціацій: як швидко вивчити англійську мову
Все про властивості елементів періодичної системи
Властивості хімічних елементів можуть змінюватись. Спочатку визначимо, якими ж вони бувають?
- Металеві (відновлювальні) – здатність атома віддавати електрони.
- Неметалічні (окислювальні) – здатність приймати електрони.
- Електронегативність – здатність притягувати до себе електрони від атомів інших елементів.
Дивлячись на таблицю елементів, у кожному періоді спостерігається закономірність властивостей. Так, якщо дивитися зліва направо, у ряді можна помітити такі особливості:
- зростає заряд ядра;
- зростає кількість електронів на зовнішньому енергетичному рівні;
- зменшується радіус атома (що демонструє зображення нижче). Зрозуміти це досить просто: те, що в атома збільшується заряд і зростає кількість електронів на зовнішньому рівні, призводить до утворення сильнішого тяжіння між ними, що й стискає атом.
- зменшується здатність атома віддавати електрони. Іншими словами, його металеві властивості слабшають, а неметалічні навпаки – посилюються;
- зростає електронегативність атомів.
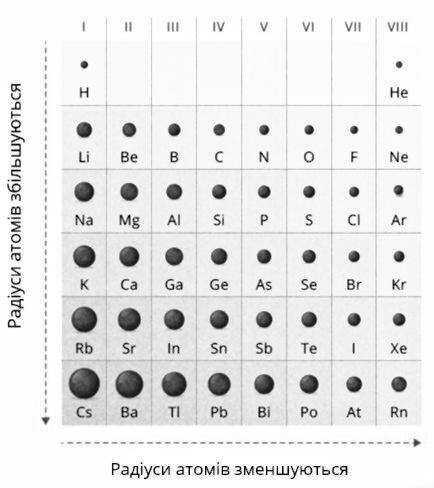
У вертикальних колонках, рухаючись зверху вниз, також можна помітити певну логічність, а саме:
- зростає заряд ядра;
- радіус стає більшим (як видно на зображенні вище);
- підвищується здатність атома віддавати електрони (тобто металеві властивості посилюються, неметалічні – навпаки). Це пов’язано з тим, що в кожного атома (що нижче) дедалі більше енергетичних рівнів (відповідних номеру періоду), у зв'язку з чим електрони зовнішнього рівня віддаляються від ядра, втрачають із ним зв'язок і в такий спосіб легше відриваються.
- спадає електронегативність атомів.
У цьому матеріалі вказана лише основна інформація про основні властивості хімічних елементів, проте якщо вам потрібно отримати глибші знання та розібратися в складних для вас моментах в цій галузі науки, варто все ж таки звернутися до репетитора з хімії.
Як запам’ятати основні елементи та значення періодичної системи?
Відразу варто зазначити, що запам'ятовувати всю таблицю нема потреби. Адже на будь-якому уроці або парі з хімії таблиця завжди знаходиться перед очима учнів (будь вона на стіні у вигляді плаката, або ж у зошиті у вигляді роздруківки). Ось декілька методів, які допоможуть вам запам'ятати якщо не всі, то хоча б основні елементи періодичної системи:
- Повторення. Це найпростіший спосіб, знайомий усім ще з дитинства. Беріть кілька елементів (наприклад, 5 штук) і вимовляйте їх назви вголос. Щоб залучити ще й зорову пам'ять, можна створювати власні картки, що відповідають коміркам у таблиці.
- Візуалізація та асоціація. Самі хімічні елементи складно якось візуалізувати, тому ви вигадуєте співзвучні образи під них і створюєте цілісну історію. Таким чином вдасться вивчити цілий період з таблиці.
Дуже часто ті учні та студенти, які хочуть покращити свої знання з хімії, користуються послугами репетиторів. Для того, щоб знайти потрібного викладача, достатньо зайти на головну сторінку платформи BUKI та скористатися зручним пошуком. Крім того, вам можуть стати у пригоді прості у використанні мобільні додатки, такі як:
- "Таблиця Менделєєва". Крім самої таблиці періодичної системи тут міститься дуже багато корисної інформації. Відкриваючи кожен хімічний елемент, ви можете ознайомитися з його коротким описом, зображенням, безліччю властивостей, тривимірною моделлю кристалічних ґраток, моделлю електронної оболонки, а також цікавими відомостями про поширеність елемента в природі (наприклад, земна кора складається з натрію на 2.3%, а у світовому океані він міститься у кількості 1.1%). Саму таблицю можна відсортувати за потрібною вам категорією елементів, які підсвічуватимуться певним кольором.
- "Таблиця Менделєєва. Хімія у кишені”. Цей додаток має практично той же функціонал, що й попередній, проте відрізняється більш яскравим візуалом. Відмінність полягає і в тому, що зображення і фото доступні тільки в платній версії, зате будь-який елемент тут можна знайти просто через пошук (за назвою, символом або атомним номером).
- "Periodic Table Quiz". У порівнянні з першими двома програмами для смартфонів, ця є тренажером, а не шпаргалкою. Вона знадобиться тим учням, які мають на меті вивчити таблицю. За допомогою 20-секундних вікторин ви зможете запам'ятати назви, символи, порядкові номери таблиці та атомні маси хімічних елементів. Прогрес у вивченні можна відстежувати, адже в таблиці кожен елемент підсвічується певним кольором (від зеленого до червоного), де зазначено у відсотковому співвідношенні, наскільки добре ви запам'ятали вміст тої чи іншої комірки.
Читайте також: Техніка швидкого читання: поради та онлайн-тренажери




